技术专题
CRISPR/Cas9基因编辑器及其原理简介
CRISPR简介
CRISPR(Clustered regularly interspaced short palindromic repeats),被称为规律成簇间隔短回文重复,实际上就是一种基因编辑器,是细菌用以保护自身对抗病毒的一个系统,也是一种对付攻击者的基因武器。后来,研究人员发现,它似乎是一种精确的万能基因武器,可以用来删除、添加、激活或抑制其他生物体的目标基因,这些目标基因包括人、老鼠、斑马鱼、细菌、果蝇、酵母、线虫和农作物细胞内的基因,这也意味着基因编辑器是一种可以广泛使用的生物技术。

CRISPR担当细菌的防护罩
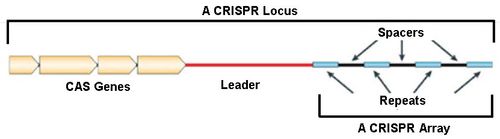
CRISPR簇是一个广泛存在于细菌和古生菌基因组中的特殊DNA重复序列家族,其序列由一个前导区(Leader)、多个短而高度保守的重复序列区(Repeat)和多个间隔区(Spacer)组成。前导区一般位于CRISPR簇上游,是富含AT长度为300~500bp的区域,被认为可能是CRISPR簇的启动子序列。重复序列区长度为21~48bp,含有回文序列,可形成发卡结构。重复序列之间被长度为26~72bp的间隔区隔开。Spacer区域由俘获的外源DNA组成,类似免疫记忆,当含有同样序列的外源DNA入侵时,可被细菌机体识别,并进行剪切使之表达沉默,达到保护自身安全的目的。
通过对CRISPR簇的侧翼序列分析发现,在其附近存在一个多态性家族基因。该家族编码的蛋白质均含有可与核酸发生作用的功能域(具有核酸酶、解旋酶、整合酶和聚合酶等活性),并且与CRISPR区域共同发挥作用,因此被命名为CRISPR关联基因(CRISPR associated),缩写为Cas。目前发现的Cas包括Cas1~Cas10等多种类型。Cas基因与CRISPR共同进化,共同构成一个高度保守的系统。
CRISPR的工作原理
当细菌抵御噬菌体等外源DNA入侵时,在前导区的调控下,CRISPR被转录为长的RNA前体(Pre RISPR RNA,pre-crRNA),然后加工成一系列短的含有保守重复序列和间隔区的成熟crRNA,最终识别并结合到与其互补的外源DNA序列上发挥剪切作用。
目前发现的CRISPR/Cas系统有三种不同类型即I型、II型和III型,它们存在于大约40%已测序的真细菌和90%已测序的古细菌中。其中II型的组成较为简单,以Cas9蛋白以及向导RNA(gRNA)为核心组成,也是目前研究中最深入的类型。
在II型系统中pre-crRNA的加工由Cas家族中的Cas9单独参与。Cas9含有在氨基末端的RuvC和蛋白质中部的HNH2个独特的活性位点,在crRNA成熟和双链DNA剪切中发挥作用。此外,pre-crRNA转录的同时,与其重复序列互补的反式激活crRNA(Trans-activating crRNA,tracrRNA)也转录出来,并且激发Cas9和双链RNA特异性RNase III核酸酶对pre-crRNA进行加工。加工成熟后,crRNA、tracrRNA和Cas9组成复合体,识别并结合于crRNA互补的序列,然后解开DNA双链,形成R-loop,使crRNA与互补链杂交,另一条链保持游离的单链状态,然后由Cas9中的HNH活性位点剪切crRNA的互补DNA链,RuvC活性位点剪切非互补链,最终引入DNA双链断裂(DSB)。CRISPR/Cas9的剪切位点位于crRNA互补序列下游邻近的PAM区(Protospacer Adjacent Motif)的5'-GG-N18-NGG-3'特征区域中的NGG位点,而这种特征的序列在每128bp的随机DNA序列中就重复出现一次。研究结果表明,Cas9还可以剪切线性和超螺旋的质粒,其剪切效率堪比限制性内切酶。
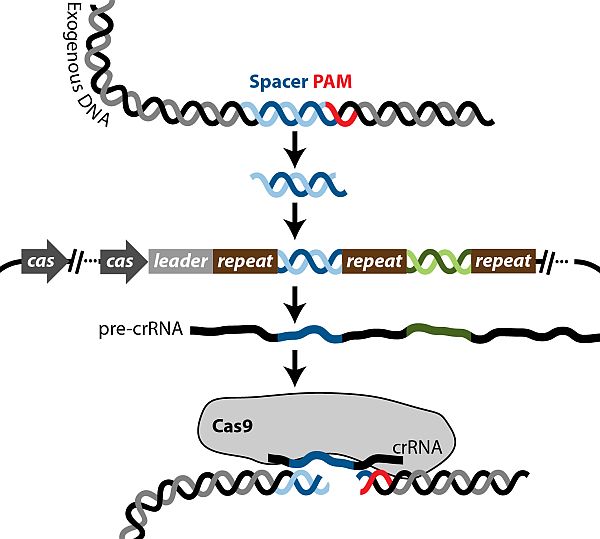
由于crRNA参与并且起到精确导向的作用,所以CRISPR/Cas9打靶系统也被称为RNA导向(RNA guided)打靶系统。
