技术专题
科学家发现HIV病毒的帮凶:肠道菌群
近日,一项发表在国际杂志Cell Host & Microbe上的研究报告中,来自杜克大学人类疫苗研究所的研究人员通过研究表示,机体肠道中的正常微生物群或许在人类机体免疫系统抵御HIV感染的过程中扮演着重要作用,研究人员表示,此前他们开发的抵御HIV感染的抗体并没有有效地控制感染的发生。
这些无效的抗体仅仅可以作用于病毒的外包膜gp41蛋白,而该蛋白可以很快发生突变,而且HIV可以逃逸抗体的中和作用,这也就表明,HIV在逃脱疗法作用的过程中可能存在“帮凶”,研究者推测这个“帮凶”或许是机体肠道中的天然微生物菌群。
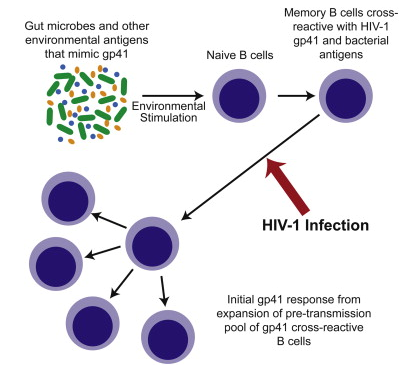
Barton F. Haynes博士表示,肠道菌群可以通过帮助机体免疫系统发育来维持机体健康,同时也会刺激一些免疫细胞对细菌进行监视,但是这项研究中我们却发现同细菌相互作用的抗体也会和HIV的外膜发生交叉反应。我们的机体可以通过天然B细胞的发育来抵御感染,随后机体会对病原体产生长效记忆,以便下次相同的病原体再次入侵时被机体的免疫细胞及时“歼灭”。
但是当HIV病毒入侵机体时会在胃肠道内开启复制模式,这时机体并不会出动天然B细胞来“迎战”,相反预先存在的记忆B细胞会产生反应,这些记忆B细胞就和抵御细菌感染而产生的记忆B细胞相同。因为HIV上有免疫系统可以靶向作用的区域,因此病毒外膜蛋白gp41就会模拟细菌细胞表面的抗原,随后B细胞就会对病毒产生反应,产生一些不具有保护效力的抗体,因为B细胞是对HIV表面的非保护区域靶向作用而产生的抗体。
研究人员表示,他们随后会对未感染HIV的个体进行研究来确定,在未感染HIV的人中,研究者可以分离出和肠道细菌发生交叉反应的突变gp41肠道菌群抗体;作者Ashley M. Trama指出,我们假设,在HIV感染反应中产生的gp41抗体或许是由于肠道菌群和HIV外膜发生交叉反应而促进记忆B细胞产生的,这就表明,主要的HIV抗体反应实际上会受到HIV感染之前机体的活性记忆B细胞而影响,而且其还会和肠道菌群发生交叉反应。
这项研究或为开发新型HIV的疫苗提供一定的线索和希望,最后研究者表示,这项研究不仅揭示了肠道菌群会影响免疫系统的功能发育,而且还揭示了其会和某些病毒比如HIV产生交叉反应来影响机体的健康。
HIV-1 Envelope gp41 Antibodies Can Originate from Terminal Ileum B Cells that Share Cross-Reactivity with Commensal Bacteria
Ashley M. Trama, M. Anthony Moody, S. Munir Alam, Frederick H. Jaeger, Bradley Lockwood, Robert Parks, Krissey E. Lloyd, Christina Stolarchuk, Richard Scearce, Andrew Foulger, Dawn J. Marshall, John F. Whitesides, Thomas L. Jeffries Jr., Kevin Wiehe, Lynn Morris, Bronwen Lambson, Kelly Soderberg, Kwan-Ki Hwang, Georgia D. Tomaras, Nathan Vandergrift, Katherine J.L. Jackson, Krishna M. Roskin, Scott D. Boyd, Thomas B. Kepler, Hua-Xin Liao, Barton F. Haynes
Monoclonal antibodies derived from blood plasma cells of acute HIV-1-infected individuals are predominantly targeted to the HIV Env gp41 and cross-reactive with commensal bacteria. To understand this phenomenon, we examined anti-HIV responses in ileum B cells using recombinant antibody technology and probed their relationship to commensal bacteria. The dominant ileum B cell response was to Env gp41. Remarkably, a majority (82%) of the ileum anti-gp41 antibodies cross-reacted with commensal bacteria, and of those, 43% showed non-HIV-1 antigen polyreactivity. Pyrosequencing revealed shared HIV-1 antibody clonal lineages between ileum and blood. Mutated immunoglobulin G antibodies cross-reactive with both Env gp41 and microbiota could also be isolated from the ileum of HIV-1 uninfected individuals. Thus, the gp41 commensal bacterial antigen cross-reactive antibodies originate in the intestine, and the gp41 Env response in HIV-1 infection can be derived from a preinfection memory B cell pool triggered by commensal bacteria that cross-react with Env.
