技术专题
Cell metabolism:科学家发现衰老过程中维持肌肉功能的关键分子
肌肉中的AMPK对于饥饿状态下自噬的诱导发生非常重要
饥饿状态下,AMPK对于促进蛋白水解维持血糖平衡具有重要作用
AMPK缺失会加速衰老诱导的肌病发生以及线粒体功能紊乱
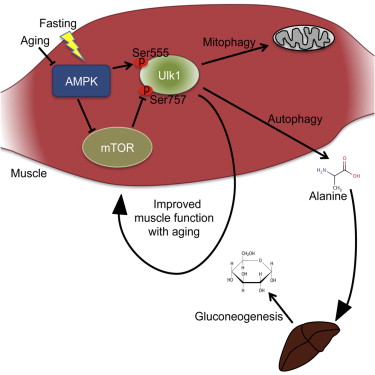
近日,来自加拿大的科学家在国际学术期刊cell metabolism发表了一项最新研究进展,他们通过研究发现蛋白激酶AMPK所介导的细胞自噬在维持饥饿状态下血糖平衡以及衰老过程中肌肉和线粒体的正常功能方面具有非常重要的作用,研究人员对其中的机制进行了深入分析。
在之前的一些研究中已经发现AMPK能够激活自噬过程,但AMPK激活的自噬过程对于衰老和饥饿状态下肌肉功能发挥的影响还没有研究。在该项研究中,研究人员发现饥饿状态下,如果小鼠肌肉中缺失AMPK会导致低血糖症和酮过量。
研究人员通过研究证明这一表型的出现并非因为脂肪酸氧化存在障碍,而是肌肉中蛋白质水解过程受到阻断,循环系统中丙氨酸含量减少所导致,而丙氨酸是参与糖异生过程的一种重要氨基酸。
研究人员还发现肌肉中自噬的标记物,包括ULK1的555位丝氨酸和757位丝氨酸的磷酸化以及LC3的聚集均发生障碍,而与这一现象一致的是,AMPK-MKO小鼠在衰老过程中也会出现肌肉功能下降,线粒体疾病以及通过自噬进行降解的蛋白p62和parkin产生积累等肌病具有的表型。
这些结果表明,骨骼肌AMPK介导的自噬过程在维持饥饿状态下血糖平衡具有重要作用,同时对于维持衰老过程中肌肉以及线粒体正常功能也有重要意义。
AMPK Activation of Muscle Autophagy Prevents Fasting-Induced Hypoglycemia and Myopathy during Aging
Adam L. Bujak, Justin D. Crane, James S. Lally, Rebecca J. Ford, Sally J. Kang, Irena A. Rebalka, Alex E. Green, Bruce E. Kemp, Thomas J. Hawke, Jonathan D. Schertzer, Gregory R. Steinberg
The AMP-activated protein kinase (AMPK) activates autophagy, but its role in aging and fasting-induced muscle function has not been defined. Here we report that fasting mice lacking skeletal muscle AMPK (AMPK-MKO) results in hypoglycemia and hyperketosis. This is not due to defective fatty acid oxidation, but instead is related to a block in muscle proteolysis that leads to reduced circulating levels of alanine, an essential amino acid required for gluconeogenesis. Markers of muscle autophagy including phosphorylation of Ulk1 Ser555 and Ser757 and aggregation of RFP-LC3 puncta are impaired. Consistent with impaired autophagy, aged AMPK-MKO mice possess a significant myopathy characterized by reduced muscle function, mitochondrial disease, and accumulation of the autophagy/mitophagy proteins p62 and Parkin. These findings establish an essential requirement for skeletal muscle AMPK-mediated autophagy in preserving blood glucose levels during prolonged fasting as well as maintaining muscle integrity and mitochondrial function during aging.
